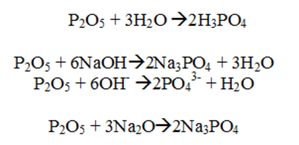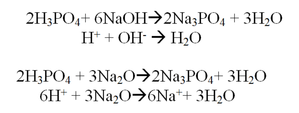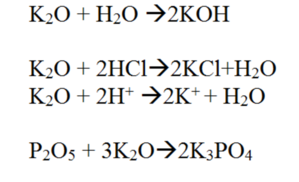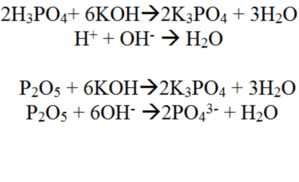Задание
Развернуть задание
Дайте характеристику элементов : а) фосфора ; б) калия.
Развернуть задание
Новое решение
Решение
Характеризуя химический элемент, можно использовать следующий план.
1. Положение элемента в Периодической системе Д. И. Менделеева, строение атома.
2. Характер простого вещества (металл, неметалл).
3. Сравнение свойств простого вещества со свойствами простых веществ, образованных соседними по подгруппе элементами.
4. Сравнение свойств простого вещества со свойствами простых веществ, образованных соседними по периоду элементами.
5. Состав высшего оксида, его характер.
6. Состав высшего гидроксида, его характер.
7. Состав летучего водородного соединения (если неметалл).
Фосфор.
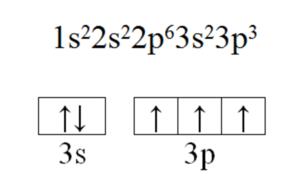
1. Фосфор — элемент VA группы (главной подгруппы) 3-го периода (малого), Z = 15, A = 31 (массовое число). Заряд ядра атома +15 (число протонов). Число нейтронов в ядре равно N = A – Z = 16. Число электронов равно числу протонов, т. е. равно 15. Строение его электронной оболочки
15P 2ē; 8ē; 5ē.
Электронная формула и строение внешнего энергетического уровня: См. Рис.2
2. Атомы фосфора проявляют как окислительные свойства, (т. е. принимают недостающие до завершения внешнего уровня 3 электрона, получая при этом степень окисления -3: P^0+3 ē -> P^(3-), например, в соединениях с металлами (AlP, Mg_3P_2) или менее электроотрицательными элементами-неметаллами (PH_3)), так и восстановительные свойства, (т. е. отдают 1, 3 или все 5 внешних электронов более электроотрицательным элементам, например, кислороду, галогенам), приобретая степени окисления +1 (H_3PO_2), +3 (P_2O_3), +5(P_2O_5). Восстановительные свойства выражены лучше, чем окислительные. В реакциях с щелочами диспропорционирует.
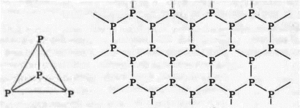
3. Фосфор — простое вещество, неметалл. Свойственно явление аллотропии. При этом простые вещества, образованные фосфором, имеют различные свойства из-за неодинакового строения : См. Рис.1
P_4 - молекулярное твёрдое вещество, наиболее реакционноспособная форма фосфора. Молекула неустойчива из-за напряженных валентных углов.
P_черный - немолекулярное вещество, слоистый полимер, атомы фосфора в слоях образуют гофрированные сетки. Очень устойчивая форма.
P_кр - немолекулярное вещество, полимерное соединение, структура сильно зависит от способа получения. По реакционной способности занимает промежуточное положение между двумя другими модификациями фосфора.
4. Неметаллические свойства у фосфора выражены слабее, чем у азота, но сильнее, чем у мышьяка: N>P>As
5. Неметаллические свойства у фосфора выражены сильнее, чем у кремния, но слабее, чем у серы: Si>P>S
6. Высший оксид фосфора — P_2O_5 , обладает типичными кислотными свойствами, т. е. вступает в реакции с гидроксидами, при этом одним из продуктом реакции является соль, растворяется в воде, получая в результате кислоту, и реагирует с основными оксидами. Уравнения реакций См. Рис.4
7. Высший гидроксид фосфора — ортофосфорная кислота H_3PO_4. Её раствор проявляет все типичные свойства кислот (взаимодействует с основными и амфотерными оксидами, взаимодействует с щелочами и нерастворимыми основаниями , с металлами). Уравнения реакций См. Рис.5
8.Фосфор образует летучее водородное соединение — фосфин PH_3.
Калий.
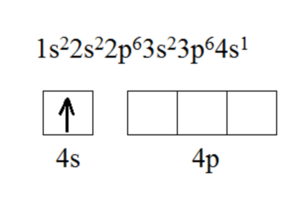
1.Калий — элемент IA группы и 4-го периода, Z = 19, A = 39 (массовое число). Заряд ядра атома +19 (число протонов). Число нейтронов в ядре равно N = A – Z = 20. Число электронов равно числу протонов, т. е. равно 19. Строение его электронной оболочки :
19К 2ē; 8ē; 8ē; 1ē.
Электронная формула и строение внешнего энергетического уровня: См. Рис.3
2. Калий проявляет восстановительные свойства, при этом он отдает 1 внешний электрон и приобретает степень окисления +1: K^0-1 ē -> K^+
3. Калий — простое вещество, металл. Характерна металлическая кристаллическая решётка, металлическая химическая связь, проявляет типичные свойства металлов (физические: металлический блеск, высокая тепло и электропроводность, химические: активно реагирует с кислотами).
4. Металлические свойства у калия выражены сильнее, чем у натрия, но слабее, чем у рубидия вследствие увеличения радиуса вниз по подгруппе щелочных металлов Na<K<Rb
5. Металлические свойства у калия выражены сильнее, чем у кальция, т. к. по периоду радиус атома уменьшается. Элементу, чей радиус больше, легче отдавать электроны K>Ca
6. Высший оксид — K_2O. Основный оксид, проявляет типичные свойства основных оксидов (растворяется в воде, реагирует с кислотами, кислотными и амфотерными оксидами). Уравнения реакций См. Рис.6
7. Гидроксид — KOH (едкое кали), проявляет все свойства оснований. ( реагирует с кислотами, кислотными и амфотерными оксидами).
8. Летучего водородного соединения калий не образует.
1. Положение элемента в Периодической системе Д. И. Менделеева, строение атома.
2. Характер простого вещества (металл, неметалл).
3. Сравнение свойств простого вещества со свойствами простых веществ, образованных соседними по подгруппе элементами.
4. Сравнение свойств простого вещества со свойствами простых веществ, образованных соседними по периоду элементами.
5. Состав высшего оксида, его характер.
6. Состав высшего гидроксида, его характер.
7. Состав летучего водородного соединения (если неметалл).
Фосфор.
1. Фосфор — элемент VA группы (главной подгруппы) 3-го периода (малого), Z = 15, A = 31 (массовое число). Заряд ядра атома +15 (число протонов). Число нейтронов в ядре равно N = A – Z = 16. Число электронов равно числу протонов, т. е. равно 15. Строение его электронной оболочки
15P 2ē; 8ē; 5ē.
Электронная формула и строение внешнего энергетического уровня: См. Рис.2
2. Атомы фосфора проявляют как окислительные свойства, (т. е. принимают недостающие до завершения внешнего уровня 3 электрона, получая при этом степень окисления -3: P^0+3 ē -> P^(3-), например, в соединениях с металлами (AlP, Mg_3P_2) или менее электроотрицательными элементами-неметаллами (PH_3)), так и восстановительные свойства, (т. е. отдают 1, 3 или все 5 внешних электронов более электроотрицательным элементам, например, кислороду, галогенам), приобретая степени окисления +1 (H_3PO_2), +3 (P_2O_3), +5(P_2O_5). Восстановительные свойства выражены лучше, чем окислительные. В реакциях с щелочами диспропорционирует.
3. Фосфор — простое вещество, неметалл. Свойственно явление аллотропии. При этом простые вещества, образованные фосфором, имеют различные свойства из-за неодинакового строения : См. Рис.1
P_4 - молекулярное твёрдое вещество, наиболее реакционноспособная форма фосфора. Молекула неустойчива из-за напряженных валентных углов.
P_черный - немолекулярное вещество, слоистый полимер, атомы фосфора в слоях образуют гофрированные сетки. Очень устойчивая форма.
P_кр - немолекулярное вещество, полимерное соединение, структура сильно зависит от способа получения. По реакционной способности занимает промежуточное положение между двумя другими модификациями фосфора.
4. Неметаллические свойства у фосфора выражены слабее, чем у азота, но сильнее, чем у мышьяка: N>P>As
5. Неметаллические свойства у фосфора выражены сильнее, чем у кремния, но слабее, чем у серы: Si>P>S
6. Высший оксид фосфора — P_2O_5 , обладает типичными кислотными свойствами, т. е. вступает в реакции с гидроксидами, при этом одним из продуктом реакции является соль, растворяется в воде, получая в результате кислоту, и реагирует с основными оксидами. Уравнения реакций См. Рис.4
7. Высший гидроксид фосфора — ортофосфорная кислота H_3PO_4. Её раствор проявляет все типичные свойства кислот (взаимодействует с основными и амфотерными оксидами, взаимодействует с щелочами и нерастворимыми основаниями , с металлами). Уравнения реакций См. Рис.5
8.Фосфор образует летучее водородное соединение — фосфин PH_3.
Калий.
1.Калий — элемент IA группы и 4-го периода, Z = 19, A = 39 (массовое число). Заряд ядра атома +19 (число протонов). Число нейтронов в ядре равно N = A – Z = 20. Число электронов равно числу протонов, т. е. равно 19. Строение его электронной оболочки :
19К 2ē; 8ē; 8ē; 1ē.
Электронная формула и строение внешнего энергетического уровня: См. Рис.3
2. Калий проявляет восстановительные свойства, при этом он отдает 1 внешний электрон и приобретает степень окисления +1: K^0-1 ē -> K^+
3. Калий — простое вещество, металл. Характерна металлическая кристаллическая решётка, металлическая химическая связь, проявляет типичные свойства металлов (физические: металлический блеск, высокая тепло и электропроводность, химические: активно реагирует с кислотами).
4. Металлические свойства у калия выражены сильнее, чем у натрия, но слабее, чем у рубидия вследствие увеличения радиуса вниз по подгруппе щелочных металлов Na<K<Rb
5. Металлические свойства у калия выражены сильнее, чем у кальция, т. к. по периоду радиус атома уменьшается. Элементу, чей радиус больше, легче отдавать электроны K>Ca
6. Высший оксид — K_2O. Основный оксид, проявляет типичные свойства основных оксидов (растворяется в воде, реагирует с кислотами, кислотными и амфотерными оксидами). Уравнения реакций См. Рис.6
7. Гидроксид — KOH (едкое кали), проявляет все свойства оснований. ( реагирует с кислотами, кислотными и амфотерными оксидами).
8. Летучего водородного соединения калий не образует.
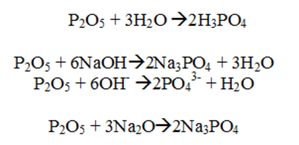
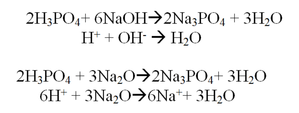
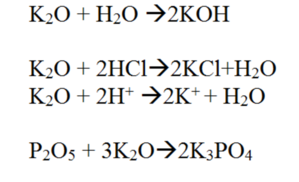
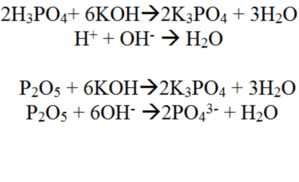
Характеризуя химический элемент, можно использовать следующий план.
1. Положение элемента в Периодической системе Д. И. Менделеева, строение атома.
2. Характер простого вещества (металл, неметалл).
3. Сравнение свойств простого вещества со свойствами простых веществ, образованных соседними по подгруппе элементами.
4. Сравнение свойств простого вещества со свойствами простых веществ, образованных соседними по периоду элементами.
5. Состав высшего оксида, его характер.
6. Состав высшего гидроксида, его характер.
7. Состав летучего водородного соединения (если неметалл).
Фосфор.
1. Фосфор — элемент VA группы (главной подгруппы) 3-го периода (малого), Z = 15, A = 31 (массовое число). Заряд ядра атома +15 (число протонов). Число нейтронов в ядре равно N = A – Z = 16. Число электронов равно числу протонов, т. е. равно 15. Строение его электронной оболочки
15P 2ē; 8ē; 5ē.
Электронная формула и строение внешнего энергетического уровня: См. Рис.2
2. Атомы фосфора проявляют как окислительные свойства, (т. е. принимают недостающие до завершения внешнего уровня 3 электрона, получая при этом степень окисления -3: P^0+3 ē -> P^(3-), например, в соединениях с металлами (AlP, Mg_3P_2) или менее электроотрицательными элементами-неметаллами (PH_3)), так и восстановительные свойства, (т. е. отдают 1, 3 или все 5 внешних электронов более электроотрицательным элементам, например, кислороду, галогенам), приобретая степени окисления +1 (H_3PO_2), +3 (P_2O_3), +5(P_2O_5). Восстановительные свойства выражены лучше, чем окислительные. В реакциях с щелочами диспропорционирует.
3. Фосфор — простое вещество, неметалл. Свойственно явление аллотропии. При этом простые вещества, образованные фосфором, имеют различные свойства из-за неодинакового строения : См. Рис.1
P_4 - молекулярное твёрдое вещество, наиболее реакционноспособная форма фосфора. Молекула неустойчива из-за напряженных валентных углов.
P_черный - немолекулярное вещество, слоистый полимер, атомы фосфора в слоях образуют гофрированные сетки. Очень устойчивая форма.
P_кр - немолекулярное вещество, полимерное соединение, структура сильно зависит от способа получения. По реакционной способности занимает промежуточное положение между двумя другими модификациями фосфора.
4. Неметаллические свойства у фосфора выражены слабее, чем у азота, но сильнее, чем у мышьяка: N>P>As
5. Неметаллические свойства у фосфора выражены сильнее, чем у кремния, но слабее, чем у серы: Si>P>S
6. Высший оксид фосфора — P_2O_5 , обладает типичными кислотными свойствами, т. е. вступает в реакции с гидроксидами, при этом одним из продуктом реакции является соль, растворяется в воде, получая в результате кислоту, и реагирует с основными оксидами. Уравнения реакций См. Рис.4
7. Высший гидроксид фосфора — ортофосфорная кислота H_3PO_4. Её раствор проявляет все типичные свойства кислот (взаимодействует с основными и амфотерными оксидами, взаимодействует с щелочами и нерастворимыми основаниями , с металлами). Уравнения реакций См. Рис.5
8.Фосфор образует летучее водородное соединение — фосфин PH_3.
Калий.
1.Калий — элемент IA группы и 4-го периода, Z = 19, A = 39 (массовое число). Заряд ядра атома +19 (число протонов). Число нейтронов в ядре равно N = A – Z = 20. Число электронов равно числу протонов, т. е. равно 19. Строение его электронной оболочки :
19К 2ē; 8ē; 8ē; 1ē.
Электронная формула и строение внешнего энергетического уровня: См. Рис.3
2. Калий проявляет восстановительные свойства, при этом он отдает 1 внешний электрон и приобретает степень окисления +1: K^0-1 ē -> K^+
3. Калий — простое вещество, металл. Характерна металлическая кристаллическая решётка, металлическая химическая связь, проявляет типичные свойства металлов (физические: металлический блеск, высокая тепло и электропроводность, химические: активно реагирует с кислотами).
4. Металлические свойства у калия выражены сильнее, чем у натрия, но слабее, чем у рубидия вследствие увеличения радиуса вниз по подгруппе щелочных металлов Na<K<Rb
5. Металлические свойства у калия выражены сильнее, чем у кальция, т. к. по периоду радиус атома уменьшается. Элементу, чей радиус больше, легче отдавать электроны K>Ca
6. Высший оксид — K_2O. Основный оксид, проявляет типичные свойства основных оксидов (растворяется в воде, реагирует с кислотами, кислотными и амфотерными оксидами). Уравнения реакций См. Рис.6
7. Гидроксид — KOH (едкое кали), проявляет все свойства оснований. ( реагирует с кислотами, кислотными и амфотерными оксидами).
8. Летучего водородного соединения калий не образует.
1. Положение элемента в Периодической системе Д. И. Менделеева, строение атома.
2. Характер простого вещества (металл, неметалл).
3. Сравнение свойств простого вещества со свойствами простых веществ, образованных соседними по подгруппе элементами.
4. Сравнение свойств простого вещества со свойствами простых веществ, образованных соседними по периоду элементами.
5. Состав высшего оксида, его характер.
6. Состав высшего гидроксида, его характер.
7. Состав летучего водородного соединения (если неметалл).
Фосфор.
1. Фосфор — элемент VA группы (главной подгруппы) 3-го периода (малого), Z = 15, A = 31 (массовое число). Заряд ядра атома +15 (число протонов). Число нейтронов в ядре равно N = A – Z = 16. Число электронов равно числу протонов, т. е. равно 15. Строение его электронной оболочки
15P 2ē; 8ē; 5ē.
Электронная формула и строение внешнего энергетического уровня: См. Рис.2
2. Атомы фосфора проявляют как окислительные свойства, (т. е. принимают недостающие до завершения внешнего уровня 3 электрона, получая при этом степень окисления -3: P^0+3 ē -> P^(3-), например, в соединениях с металлами (AlP, Mg_3P_2) или менее электроотрицательными элементами-неметаллами (PH_3)), так и восстановительные свойства, (т. е. отдают 1, 3 или все 5 внешних электронов более электроотрицательным элементам, например, кислороду, галогенам), приобретая степени окисления +1 (H_3PO_2), +3 (P_2O_3), +5(P_2O_5). Восстановительные свойства выражены лучше, чем окислительные. В реакциях с щелочами диспропорционирует.
3. Фосфор — простое вещество, неметалл. Свойственно явление аллотропии. При этом простые вещества, образованные фосфором, имеют различные свойства из-за неодинакового строения : См. Рис.1
P_4 - молекулярное твёрдое вещество, наиболее реакционноспособная форма фосфора. Молекула неустойчива из-за напряженных валентных углов.
P_черный - немолекулярное вещество, слоистый полимер, атомы фосфора в слоях образуют гофрированные сетки. Очень устойчивая форма.
P_кр - немолекулярное вещество, полимерное соединение, структура сильно зависит от способа получения. По реакционной способности занимает промежуточное положение между двумя другими модификациями фосфора.
4. Неметаллические свойства у фосфора выражены слабее, чем у азота, но сильнее, чем у мышьяка: N>P>As
5. Неметаллические свойства у фосфора выражены сильнее, чем у кремния, но слабее, чем у серы: Si>P>S
6. Высший оксид фосфора — P_2O_5 , обладает типичными кислотными свойствами, т. е. вступает в реакции с гидроксидами, при этом одним из продуктом реакции является соль, растворяется в воде, получая в результате кислоту, и реагирует с основными оксидами. Уравнения реакций См. Рис.4
7. Высший гидроксид фосфора — ортофосфорная кислота H_3PO_4. Её раствор проявляет все типичные свойства кислот (взаимодействует с основными и амфотерными оксидами, взаимодействует с щелочами и нерастворимыми основаниями , с металлами). Уравнения реакций См. Рис.5
8.Фосфор образует летучее водородное соединение — фосфин PH_3.
Калий.
1.Калий — элемент IA группы и 4-го периода, Z = 19, A = 39 (массовое число). Заряд ядра атома +19 (число протонов). Число нейтронов в ядре равно N = A – Z = 20. Число электронов равно числу протонов, т. е. равно 19. Строение его электронной оболочки :
19К 2ē; 8ē; 8ē; 1ē.
Электронная формула и строение внешнего энергетического уровня: См. Рис.3
2. Калий проявляет восстановительные свойства, при этом он отдает 1 внешний электрон и приобретает степень окисления +1: K^0-1 ē -> K^+
3. Калий — простое вещество, металл. Характерна металлическая кристаллическая решётка, металлическая химическая связь, проявляет типичные свойства металлов (физические: металлический блеск, высокая тепло и электропроводность, химические: активно реагирует с кислотами).
4. Металлические свойства у калия выражены сильнее, чем у натрия, но слабее, чем у рубидия вследствие увеличения радиуса вниз по подгруппе щелочных металлов Na<K<Rb
5. Металлические свойства у калия выражены сильнее, чем у кальция, т. к. по периоду радиус атома уменьшается. Элементу, чей радиус больше, легче отдавать электроны K>Ca
6. Высший оксид — K_2O. Основный оксид, проявляет типичные свойства основных оксидов (растворяется в воде, реагирует с кислотами, кислотными и амфотерными оксидами). Уравнения реакций См. Рис.6
7. Гидроксид — KOH (едкое кали), проявляет все свойства оснований. ( реагирует с кислотами, кислотными и амфотерными оксидами).
8. Летучего водородного соединения калий не образует.