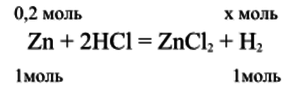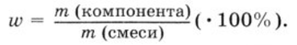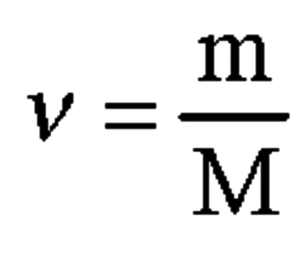Задание
Развернуть задание
Вычислить объем водорода (н.у.), который образуется при растворении 100 г латуни, содержащей 13% цинка, в соляной кислоте.
Развернуть задание
Новое решение
Решение
- Предыдущее
- Следующее
Латунь – сплав меди и цинка. В соляной кислоте может растворяться только цинк.
Дано:
ω(Zn) = 13 % или 0,13
m(сплава) = 100 г
V(H(2)) - ?
Решение:
1. Составим уравнение реакции: 1 картинка
2. Для нахождения массы цинка в сплаве можно воспользоваться формулой массовой доли компонента в сплаве, представленной на 2 картинке. Из данной формулы следует, что m(Zn) = ω(Zn) ∙ m(сплава)
m(Zn) = 100 ∙ 0,13 = 13 г
3. Вычислим количество вещества цинка Zn по формуле, представленной на 3 картинке:
n(Zn) = 13 / 65,37 = 0,2 моль
4. По уравнению реакции из 1 моль Zn образуется 1 моль H(2), тогда из 0,2 моль Zn образуется такое же количество H(2):
n(Zn) = n(H(2)) = 0,2 моль
5. Так как условия нормальные можно вычислить объем H(2) используя мольный объем:
V(H(2)) = 0,2 ∙ 22,4 = 4,48 л
Ответ: 4,48 л.
Дано:
ω(Zn) = 13 % или 0,13
m(сплава) = 100 г
V(H(2)) - ?
Решение:
1. Составим уравнение реакции: 1 картинка
2. Для нахождения массы цинка в сплаве можно воспользоваться формулой массовой доли компонента в сплаве, представленной на 2 картинке. Из данной формулы следует, что m(Zn) = ω(Zn) ∙ m(сплава)
m(Zn) = 100 ∙ 0,13 = 13 г
3. Вычислим количество вещества цинка Zn по формуле, представленной на 3 картинке:
n(Zn) = 13 / 65,37 = 0,2 моль
4. По уравнению реакции из 1 моль Zn образуется 1 моль H(2), тогда из 0,2 моль Zn образуется такое же количество H(2):
n(Zn) = n(H(2)) = 0,2 моль
5. Так как условия нормальные можно вычислить объем H(2) используя мольный объем:
V(H(2)) = 0,2 ∙ 22,4 = 4,48 л
Ответ: 4,48 л.
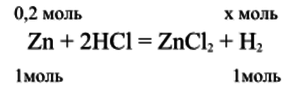
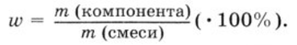
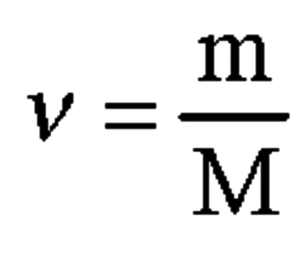
Латунь – сплав меди и цинка. В соляной кислоте может растворяться только цинк.
Дано:
ω(Zn) = 13 % или 0,13
m(сплава) = 100 г
V(H(2)) - ?
Решение:
1. Составим уравнение реакции: 1 картинка
2. Для нахождения массы цинка в сплаве можно воспользоваться формулой массовой доли компонента в сплаве, представленной на 2 картинке. Из данной формулы следует, что m(Zn) = ω(Zn) ∙ m(сплава)
m(Zn) = 100 ∙ 0,13 = 13 г
3. Вычислим количество вещества цинка Zn по формуле, представленной на 3 картинке:
n(Zn) = 13 / 65,37 = 0,2 моль
4. По уравнению реакции из 1 моль Zn образуется 1 моль H(2), тогда из 0,2 моль Zn образуется такое же количество H(2):
n(Zn) = n(H(2)) = 0,2 моль
5. Так как условия нормальные можно вычислить объем H(2) используя мольный объем:
V(H(2)) = 0,2 ∙ 22,4 = 4,48 л
Ответ: 4,48 л.
Дано:
ω(Zn) = 13 % или 0,13
m(сплава) = 100 г
V(H(2)) - ?
Решение:
1. Составим уравнение реакции: 1 картинка
2. Для нахождения массы цинка в сплаве можно воспользоваться формулой массовой доли компонента в сплаве, представленной на 2 картинке. Из данной формулы следует, что m(Zn) = ω(Zn) ∙ m(сплава)
m(Zn) = 100 ∙ 0,13 = 13 г
3. Вычислим количество вещества цинка Zn по формуле, представленной на 3 картинке:
n(Zn) = 13 / 65,37 = 0,2 моль
4. По уравнению реакции из 1 моль Zn образуется 1 моль H(2), тогда из 0,2 моль Zn образуется такое же количество H(2):
n(Zn) = n(H(2)) = 0,2 моль
5. Так как условия нормальные можно вычислить объем H(2) используя мольный объем:
V(H(2)) = 0,2 ∙ 22,4 = 4,48 л
Ответ: 4,48 л.