Ольга Используем таблицу Менделеева. Находим атомную массу элемента и умножаем на количество атомов данного элемента в молекуле. Так для каждого входящего в молекулу элемента — затем суммируем.
Например: M(N2) = 2 * 14 = 28, т. к. атомная масса азота по таблице = 14
Задание
Развернуть задание
Вычислить объем водорода (н.у.), который может быть получен при растворении в воде 120 мг кальция, если выход газа составляет 80 % от теоретически возможного.
Развернуть задание
Новое решение
Решение
- Предыдущее
- Следующее
1. Составим уравнение реакции.
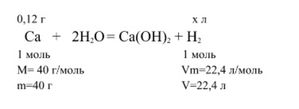
2. Вычислим объем водорода, который теоретически должен был получиться при проведении реакции. По уравнению реакции для получения H2 объемом 22,4 л требуется 40 г кальция Ca.
40 г Са образует 22,4 л H2
0,12 г Са образует x л H2
x = 0,12 ∙ 22,4 / 40 = 0,0672 л
3. По условию задачи выход газа составляет 80% от теоретически возможного, поэтому можно рассчитать практически полученный объем водорода:
Vпракт (H2) = Vтеор (H2) ∙ η(H2) = 0,0672 ∙ 0,8 = 0,05376 л = 53,76 мл
Ответ: Vпракт (H2) = 53,76 мл.
40 г Са образует 22,4 л H2
0,12 г Са образует x л H2
x = 0,12 ∙ 22,4 / 40 = 0,0672 л
3. По условию задачи выход газа составляет 80% от теоретически возможного, поэтому можно рассчитать практически полученный объем водорода:
Vпракт (H2) = Vтеор (H2) ∙ η(H2) = 0,0672 ∙ 0,8 = 0,05376 л = 53,76 мл
Ответ: Vпракт (H2) = 53,76 мл.
1. Составим уравнение реакции.
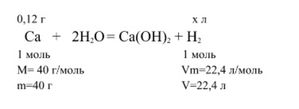
2. Вычислим объем водорода, который теоретически должен был получиться при проведении реакции. По уравнению реакции для получения H2 объемом 22,4 л требуется 40 г кальция Ca.
40 г Са образует 22,4 л H2
0,12 г Са образует x л H2
x = 0,12 ∙ 22,4 / 40 = 0,0672 л
3. По условию задачи выход газа составляет 80% от теоретически возможного, поэтому можно рассчитать практически полученный объем водорода:
Vпракт (H2) = Vтеор (H2) ∙ η(H2) = 0,0672 ∙ 0,8 = 0,05376 л = 53,76 мл
Ответ: Vпракт (H2) = 53,76 мл.
40 г Са образует 22,4 л H2
0,12 г Са образует x л H2
x = 0,12 ∙ 22,4 / 40 = 0,0672 л
3. По условию задачи выход газа составляет 80% от теоретически возможного, поэтому можно рассчитать практически полученный объем водорода:
Vпракт (H2) = Vтеор (H2) ∙ η(H2) = 0,0672 ∙ 0,8 = 0,05376 л = 53,76 мл
Ответ: Vпракт (H2) = 53,76 мл.