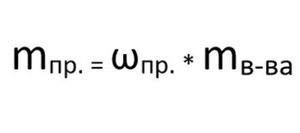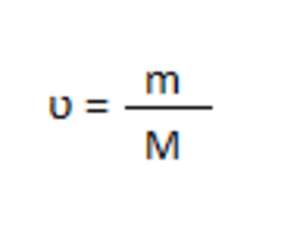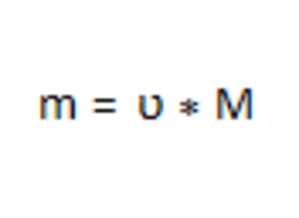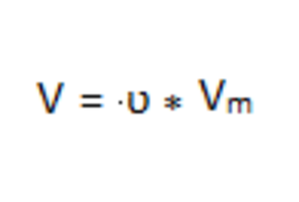Чем С2H5OH отличается от С2H6O?
Развернуть задание
Вычислите объём хлора (н. у.) и массу натрия, которые можно получить при электролизе
585 г хлорида натрия, содержащего 2% примесей.
585 г хлорида натрия, содержащего 2% примесей.
Развернуть задание
Новое решение
Решение
- Предыдущее
- Следующее
Дано:
m (NaCl) = 585 г
ω пр. = 2%
Найти:
V (Cl 2 ) - ?
m (Na) - ?
Решение:
2NaCl → 2Na + Cl 2
Найдем массу примеси по формуле: 1
m пр. = 0,02 * 585 г = 11,7 г
Зная массу примеси, найдем массу чистого хлорида натрия:
m (NaCl) = 585 г – 11,7 г = 573,3 г
Посчитаем молярную массу хлорида натрия:
М (NaCl) = 23 + 35,5 = 58,5 г/моль
Рассчитаем количество вещества хлорида натрия по формуле:2
ʋ (NaCl) = 573,3 г / 58,5 г/моль = 9,8 моль
Найдем количество вещества натрия:
ʋ (Na) : ʋ (NaCl) = 2:2 = 1:1 из этого следует, что ʋ (Na) = ʋ (NaCl) = 9,8 моль
Рассчитаем массу натрия по формуле: 3
m (Na) = 9,8 моль * 23 = 225,4 г
Найдем количество вещества хлора:
ʋ (Cl 2 ) : ʋ (Na) = 1:2 из этого следует, что ʋ (Cl 2 ) = ½ * ʋ (Na) = 9,8 моль / 2 = 4,9 моль
Рассчитаем объем хлора по формуле: 4
V (Cl 2 ) = 4,9 моль * 22,4 л/моль = 109,8 л
Ответ: V (Cl 2 ) = 109,76 л ; m (Na) = 225,4 г
m (NaCl) = 585 г
ω пр. = 2%
Найти:
V (Cl 2 ) - ?
m (Na) - ?
Решение:
2NaCl → 2Na + Cl 2
Найдем массу примеси по формуле: 1
m пр. = 0,02 * 585 г = 11,7 г
Зная массу примеси, найдем массу чистого хлорида натрия:
m (NaCl) = 585 г – 11,7 г = 573,3 г
Посчитаем молярную массу хлорида натрия:
М (NaCl) = 23 + 35,5 = 58,5 г/моль
Рассчитаем количество вещества хлорида натрия по формуле:2
ʋ (NaCl) = 573,3 г / 58,5 г/моль = 9,8 моль
Найдем количество вещества натрия:
ʋ (Na) : ʋ (NaCl) = 2:2 = 1:1 из этого следует, что ʋ (Na) = ʋ (NaCl) = 9,8 моль
Рассчитаем массу натрия по формуле: 3
m (Na) = 9,8 моль * 23 = 225,4 г
Найдем количество вещества хлора:
ʋ (Cl 2 ) : ʋ (Na) = 1:2 из этого следует, что ʋ (Cl 2 ) = ½ * ʋ (Na) = 9,8 моль / 2 = 4,9 моль
Рассчитаем объем хлора по формуле: 4
V (Cl 2 ) = 4,9 моль * 22,4 л/моль = 109,8 л
Ответ: V (Cl 2 ) = 109,76 л ; m (Na) = 225,4 г
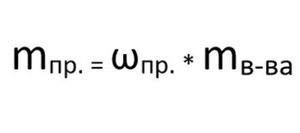
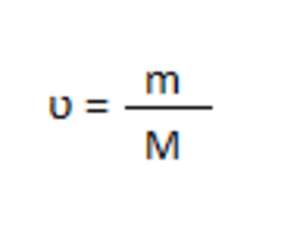
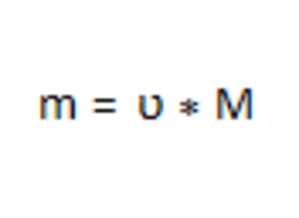
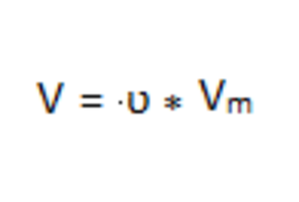
Дано:
m (NaCl) = 585 г
ω пр. = 2%
Найти:
V (Cl 2 ) - ?
m (Na) - ?
Решение:
2NaCl → 2Na + Cl 2
Найдем массу примеси по формуле: 1
m пр. = 0,02 * 585 г = 11,7 г
Зная массу примеси, найдем массу чистого хлорида натрия:
m (NaCl) = 585 г – 11,7 г = 573,3 г
Посчитаем молярную массу хлорида натрия:
М (NaCl) = 23 + 35,5 = 58,5 г/моль
Рассчитаем количество вещества хлорида натрия по формуле:2
ʋ (NaCl) = 573,3 г / 58,5 г/моль = 9,8 моль
Найдем количество вещества натрия:
ʋ (Na) : ʋ (NaCl) = 2:2 = 1:1 из этого следует, что ʋ (Na) = ʋ (NaCl) = 9,8 моль
Рассчитаем массу натрия по формуле: 3
m (Na) = 9,8 моль * 23 = 225,4 г
Найдем количество вещества хлора:
ʋ (Cl 2 ) : ʋ (Na) = 1:2 из этого следует, что ʋ (Cl 2 ) = ½ * ʋ (Na) = 9,8 моль / 2 = 4,9 моль
Рассчитаем объем хлора по формуле: 4
V (Cl 2 ) = 4,9 моль * 22,4 л/моль = 109,8 л
Ответ: V (Cl 2 ) = 109,76 л ; m (Na) = 225,4 г
m (NaCl) = 585 г
ω пр. = 2%
Найти:
V (Cl 2 ) - ?
m (Na) - ?
Решение:
2NaCl → 2Na + Cl 2
Найдем массу примеси по формуле: 1
m пр. = 0,02 * 585 г = 11,7 г
Зная массу примеси, найдем массу чистого хлорида натрия:
m (NaCl) = 585 г – 11,7 г = 573,3 г
Посчитаем молярную массу хлорида натрия:
М (NaCl) = 23 + 35,5 = 58,5 г/моль
Рассчитаем количество вещества хлорида натрия по формуле:2
ʋ (NaCl) = 573,3 г / 58,5 г/моль = 9,8 моль
Найдем количество вещества натрия:
ʋ (Na) : ʋ (NaCl) = 2:2 = 1:1 из этого следует, что ʋ (Na) = ʋ (NaCl) = 9,8 моль
Рассчитаем массу натрия по формуле: 3
m (Na) = 9,8 моль * 23 = 225,4 г
Найдем количество вещества хлора:
ʋ (Cl 2 ) : ʋ (Na) = 1:2 из этого следует, что ʋ (Cl 2 ) = ½ * ʋ (Na) = 9,8 моль / 2 = 4,9 моль
Рассчитаем объем хлора по формуле: 4
V (Cl 2 ) = 4,9 моль * 22,4 л/моль = 109,8 л
Ответ: V (Cl 2 ) = 109,76 л ; m (Na) = 225,4 г