Развернуть задание
В уксусной кислоте растворили 250 г известняка, содержащего 20% примесей, и получили при этом 36,6 л (н.у.) углекислого газа. Какую объемную долю составляет выход углекислого газа от теоретически возможного?
Развернуть задание
Новое решение
Решение
Дано:
m(известняк) = 250 г
ω(примесей) = 20%
V(CO2) = 33.6 л
φ вых(CO2) - ?
Решение:
Известняк состоит преимущественно из карбоната кальция CaCO3, значит, уравнение реакции будет выглядеть следующим образом:
m(известняк) = 250 г
ω(примесей) = 20%
V(CO2) = 33.6 л
φ вых(CO2) - ?
Решение:
Известняк состоит преимущественно из карбоната кальция CaCO3, значит, уравнение реакции будет выглядеть следующим образом:
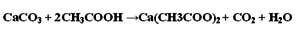
Если массовая доля примесей составляет 20%, значит, массовая доля карбоната кальция равна 80%. По формуле

найдем массу карбоната кальция
m(CaCO3) = (250 г/ 100%) * 80% = 200 г
По формуле
m(CaCO3) = (250 г/ 100%) * 80% = 200 г
По формуле
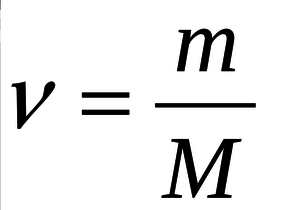
(где ν – количество вещества, m- масса вещества, M- молярная масса вещества) найдем количество вещества карбоната кальция
ν(CaCO3) = 200 г/100 г/моль = 2 моль
По реакции ν(CO2) = ν(CaCO3) = 2 моль
Найдем теоретический объем углекислого газа по формуле
ν(CaCO3) = 200 г/100 г/моль = 2 моль
По реакции ν(CO2) = ν(CaCO3) = 2 моль
Найдем теоретический объем углекислого газа по формуле
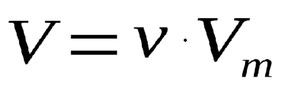
(где ν – количество вещества, V – объём газа, Vm – молярный объем)
V теор(CO2) = 2 моль * 22,4 л/моль = 44,8 л
Найдем объемную долю выхода φвых CO2 по формуле
V теор(CO2) = 2 моль * 22,4 л/моль = 44,8 л
Найдем объемную долю выхода φвых CO2 по формуле
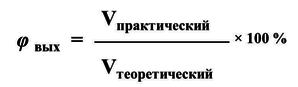
φ вых(CO2) = (33,6 л/ 44,8 л) * 100% = 75%
Ответ: 75%
Ответ: 75%
Дано:
m(известняк) = 250 г
ω(примесей) = 20%
V(CO2) = 33.6 л
φ вых(CO2) - ?
Решение:
Известняк состоит преимущественно из карбоната кальция CaCO3, значит, уравнение реакции будет выглядеть следующим образом:
m(известняк) = 250 г
ω(примесей) = 20%
V(CO2) = 33.6 л
φ вых(CO2) - ?
Решение:
Известняк состоит преимущественно из карбоната кальция CaCO3, значит, уравнение реакции будет выглядеть следующим образом:
Если массовая доля примесей составляет 20%, значит, массовая доля карбоната кальция равна 80%. По формуле

найдем массу карбоната кальция
m(CaCO3) = (250 г/ 100%) * 80% = 200 г
По формуле
m(CaCO3) = (250 г/ 100%) * 80% = 200 г
По формуле
(где ν – количество вещества, m- масса вещества, M- молярная масса вещества) найдем количество вещества карбоната кальция
ν(CaCO3) = 200 г/100 г/моль = 2 моль
По реакции ν(CO2) = ν(CaCO3) = 2 моль
Найдем теоретический объем углекислого газа по формуле
ν(CaCO3) = 200 г/100 г/моль = 2 моль
По реакции ν(CO2) = ν(CaCO3) = 2 моль
Найдем теоретический объем углекислого газа по формуле
(где ν – количество вещества, V – объём газа, Vm – молярный объем)
V теор(CO2) = 2 моль * 22,4 л/моль = 44,8 л
Найдем объемную долю выхода φвых CO2 по формуле
V теор(CO2) = 2 моль * 22,4 л/моль = 44,8 л
Найдем объемную долю выхода φвых CO2 по формуле

φ вых(CO2) = (33,6 л/ 44,8 л) * 100% = 75%
Ответ: 75%
Ответ: 75%