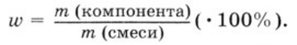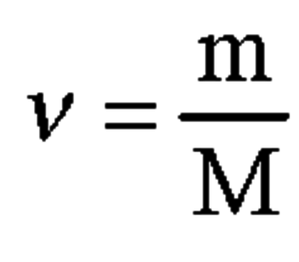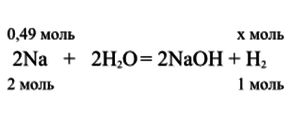Задание
Развернуть задание
Вычислить объем водорода (н.у.), который может быть получен при растворении в воде 11,5 г натрия, содержащего 2% примесей, если выход водорода составляет 95% от теоретически возможного.
Развернуть задание
Новое решение
Решение
- Предыдущее
- Следующее
Дано:
m (т.Na) = 11,5 г
ω(прим.) = 2%
η = 95 % или 0,95
Vпр(H(2)) - ?
Решение:
1. Составим уравнение реакции растворения натрия в воде (4 картинка).
2. Рассчитаем массовую долю чистого натрия в смеси:
ω(Na) = 100% - ω(прим.) = 100% - 2% = 98% или 0,98
3. Для нахождения массы чистого натрия в смеси можно использовать следующую формулу, представленную на 1 картинке:
m(Na) = m(т.Na) ∙ ω(Na) = 11,5 ∙ 0,98 = 11,27 г
4. Вычислим количество вещества натрия по формуле, представленной на 2 картинке:
M(Na) = 23г/моль
n(Na) = 11,27 / 23 = 0,49 моль
5. По уравнению реакции из 2 моль натрия образуется 1 моль водорода. Тогда, из 0,49 моль натрия образуется в 2 раза меньшее количество водорода:
n(H(2)) = 0,49 ∙ 1 / 2 = 0,245 моль
6. Найдем объема водорода, который теоретически должен был получиться в ходе реакции:
Vтеор(H(2)) = V(m) ∙ n = 0,245 ∙ 22,4 = 5,488 л
7. Определим объем водорода, который был получен практически. Так как выход газа составляет 95% от теоретически возможного, то можно воспользоваться формулой, представленной на 3 картинке:
Vпр(H(2)) = Vтеор(H(2)) ∙ η = 5,488 ∙ 0,95 = 5,2136 л
Ответ: V(H(2)) = 5,2136 л.
m (т.Na) = 11,5 г
ω(прим.) = 2%
η = 95 % или 0,95
Vпр(H(2)) - ?
Решение:
1. Составим уравнение реакции растворения натрия в воде (4 картинка).
2. Рассчитаем массовую долю чистого натрия в смеси:
ω(Na) = 100% - ω(прим.) = 100% - 2% = 98% или 0,98
3. Для нахождения массы чистого натрия в смеси можно использовать следующую формулу, представленную на 1 картинке:
m(Na) = m(т.Na) ∙ ω(Na) = 11,5 ∙ 0,98 = 11,27 г
4. Вычислим количество вещества натрия по формуле, представленной на 2 картинке:
M(Na) = 23г/моль
n(Na) = 11,27 / 23 = 0,49 моль
5. По уравнению реакции из 2 моль натрия образуется 1 моль водорода. Тогда, из 0,49 моль натрия образуется в 2 раза меньшее количество водорода:
n(H(2)) = 0,49 ∙ 1 / 2 = 0,245 моль
6. Найдем объема водорода, который теоретически должен был получиться в ходе реакции:
Vтеор(H(2)) = V(m) ∙ n = 0,245 ∙ 22,4 = 5,488 л
7. Определим объем водорода, который был получен практически. Так как выход газа составляет 95% от теоретически возможного, то можно воспользоваться формулой, представленной на 3 картинке:
Vпр(H(2)) = Vтеор(H(2)) ∙ η = 5,488 ∙ 0,95 = 5,2136 л
Ответ: V(H(2)) = 5,2136 л.
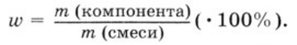
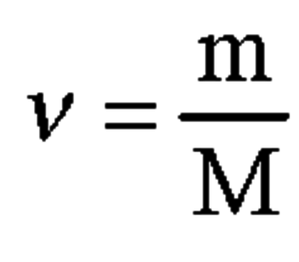

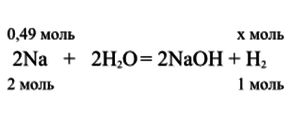
Дано:
m (т.Na) = 11,5 г
ω(прим.) = 2%
η = 95 % или 0,95
Vпр(H(2)) - ?
Решение:
1. Составим уравнение реакции растворения натрия в воде (4 картинка).
2. Рассчитаем массовую долю чистого натрия в смеси:
ω(Na) = 100% - ω(прим.) = 100% - 2% = 98% или 0,98
3. Для нахождения массы чистого натрия в смеси можно использовать следующую формулу, представленную на 1 картинке:
m(Na) = m(т.Na) ∙ ω(Na) = 11,5 ∙ 0,98 = 11,27 г
4. Вычислим количество вещества натрия по формуле, представленной на 2 картинке:
M(Na) = 23г/моль
n(Na) = 11,27 / 23 = 0,49 моль
5. По уравнению реакции из 2 моль натрия образуется 1 моль водорода. Тогда, из 0,49 моль натрия образуется в 2 раза меньшее количество водорода:
n(H(2)) = 0,49 ∙ 1 / 2 = 0,245 моль
6. Найдем объема водорода, который теоретически должен был получиться в ходе реакции:
Vтеор(H(2)) = V(m) ∙ n = 0,245 ∙ 22,4 = 5,488 л
7. Определим объем водорода, который был получен практически. Так как выход газа составляет 95% от теоретически возможного, то можно воспользоваться формулой, представленной на 3 картинке:
Vпр(H(2)) = Vтеор(H(2)) ∙ η = 5,488 ∙ 0,95 = 5,2136 л
Ответ: V(H(2)) = 5,2136 л.
m (т.Na) = 11,5 г
ω(прим.) = 2%
η = 95 % или 0,95
Vпр(H(2)) - ?
Решение:
1. Составим уравнение реакции растворения натрия в воде (4 картинка).
2. Рассчитаем массовую долю чистого натрия в смеси:
ω(Na) = 100% - ω(прим.) = 100% - 2% = 98% или 0,98
3. Для нахождения массы чистого натрия в смеси можно использовать следующую формулу, представленную на 1 картинке:
m(Na) = m(т.Na) ∙ ω(Na) = 11,5 ∙ 0,98 = 11,27 г
4. Вычислим количество вещества натрия по формуле, представленной на 2 картинке:
M(Na) = 23г/моль
n(Na) = 11,27 / 23 = 0,49 моль
5. По уравнению реакции из 2 моль натрия образуется 1 моль водорода. Тогда, из 0,49 моль натрия образуется в 2 раза меньшее количество водорода:
n(H(2)) = 0,49 ∙ 1 / 2 = 0,245 моль
6. Найдем объема водорода, который теоретически должен был получиться в ходе реакции:
Vтеор(H(2)) = V(m) ∙ n = 0,245 ∙ 22,4 = 5,488 л
7. Определим объем водорода, который был получен практически. Так как выход газа составляет 95% от теоретически возможного, то можно воспользоваться формулой, представленной на 3 картинке:
Vпр(H(2)) = Vтеор(H(2)) ∙ η = 5,488 ∙ 0,95 = 5,2136 л
Ответ: V(H(2)) = 5,2136 л.