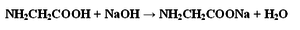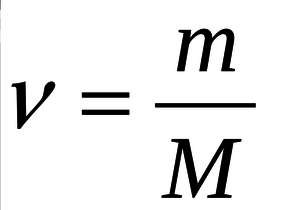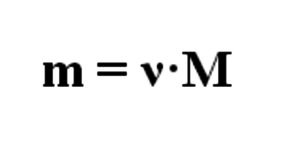Развернуть задание
Вычислите массу соли, которую можно получить при взаимодействии 150 г 5%-го раствора аминоуксусной кислоты с необходимым количеством гидроксида натрия. Сколько граммов 12%-го раствора щелочи потребуется для реакции?
Развернуть задание
Новое решение
Решение
- Предыдущее
- Следующее
Дано:
m(р)(NH(2)CH(2)COOH) = 150 г
ω(NH(2)CH(2)COOH) = 5%
ω(NaOH) = 12%
m(NH(2)CH(2)COONa) - ?
m(р)(NaOH) - ?
Решение:
Из формулы на 2 картинке следует, что масса считается по формуле, представленной на 3 картинке (где ω – массовая доля
вещества)
m(NH(2)CH(2)COOH) = (150 г/ 100%) * 5% = 7,5 г
Найдем количество вещества аминоуксусной кислоты, используя формулу на 4 картинке, где ν –количество вещества, m- масса вещества, M- молярная масса вещества)
ν(NH(2)CH(2)COOH) = 7,5 г/ 75 г/моль = 0,1 моль
Как видно из уравнения реакции количество соли равно количеству аминоуксусной кислоты
ν(NH(2)CH(2)COONa) = ν(NH(2)CH(2)COOH) = 0,1 моль
По формуле, представленной на 5 картинке, найдем массу соли
m(NH(2)CH(2)COONa) = 0,1 моль * 97 г/моль = 9,7 г
Как видно из уравнения реакции количество гидроксида натрия равно количеству аминоуксусной кислоты
ν(NaOH) = ν (NH(2)CH(2)COOH) = 0,1 моль
По формуле на 5 картинке найдем массу гидроксида натрия
m(NaOH) = 0,1 моль * 40 г/моль = 4 г
Из формулы, представленной на 2 картинке, следует, что масса раствора равна (картинка номер 6, где ω –массовая доля вещества)
m(р)(NaOH) = (4 г/ 12%) * 100% = 33,3 г
Ответ: m(NH(2)CH(2)COONa) = 9,7 г, m(р)(NaOH) = 33,3 г
m(р)(NH(2)CH(2)COOH) = 150 г
ω(NH(2)CH(2)COOH) = 5%
ω(NaOH) = 12%
m(NH(2)CH(2)COONa) - ?
m(р)(NaOH) - ?
Решение:
Из формулы на 2 картинке следует, что масса считается по формуле, представленной на 3 картинке (где ω – массовая доля
вещества)
m(NH(2)CH(2)COOH) = (150 г/ 100%) * 5% = 7,5 г
Найдем количество вещества аминоуксусной кислоты, используя формулу на 4 картинке, где ν –количество вещества, m- масса вещества, M- молярная масса вещества)
ν(NH(2)CH(2)COOH) = 7,5 г/ 75 г/моль = 0,1 моль
Как видно из уравнения реакции количество соли равно количеству аминоуксусной кислоты
ν(NH(2)CH(2)COONa) = ν(NH(2)CH(2)COOH) = 0,1 моль
По формуле, представленной на 5 картинке, найдем массу соли
m(NH(2)CH(2)COONa) = 0,1 моль * 97 г/моль = 9,7 г
Как видно из уравнения реакции количество гидроксида натрия равно количеству аминоуксусной кислоты
ν(NaOH) = ν (NH(2)CH(2)COOH) = 0,1 моль
По формуле на 5 картинке найдем массу гидроксида натрия
m(NaOH) = 0,1 моль * 40 г/моль = 4 г
Из формулы, представленной на 2 картинке, следует, что масса раствора равна (картинка номер 6, где ω –массовая доля вещества)
m(р)(NaOH) = (4 г/ 12%) * 100% = 33,3 г
Ответ: m(NH(2)CH(2)COONa) = 9,7 г, m(р)(NaOH) = 33,3 г
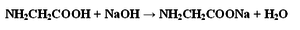


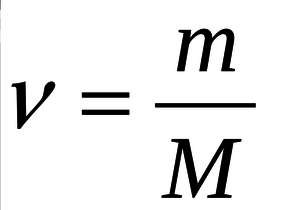
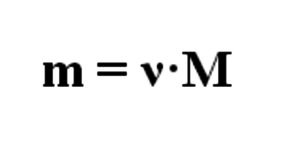

Дано:
m(р)(NH(2)CH(2)COOH) = 150 г
ω(NH(2)CH(2)COOH) = 5%
ω(NaOH) = 12%
m(NH(2)CH(2)COONa) - ?
m(р)(NaOH) - ?
Решение:
Из формулы на 2 картинке следует, что масса считается по формуле, представленной на 3 картинке (где ω – массовая доля
вещества)
m(NH(2)CH(2)COOH) = (150 г/ 100%) * 5% = 7,5 г
Найдем количество вещества аминоуксусной кислоты, используя формулу на 4 картинке, где ν –количество вещества, m- масса вещества, M- молярная масса вещества)
ν(NH(2)CH(2)COOH) = 7,5 г/ 75 г/моль = 0,1 моль
Как видно из уравнения реакции количество соли равно количеству аминоуксусной кислоты
ν(NH(2)CH(2)COONa) = ν(NH(2)CH(2)COOH) = 0,1 моль
По формуле, представленной на 5 картинке, найдем массу соли
m(NH(2)CH(2)COONa) = 0,1 моль * 97 г/моль = 9,7 г
Как видно из уравнения реакции количество гидроксида натрия равно количеству аминоуксусной кислоты
ν(NaOH) = ν (NH(2)CH(2)COOH) = 0,1 моль
По формуле на 5 картинке найдем массу гидроксида натрия
m(NaOH) = 0,1 моль * 40 г/моль = 4 г
Из формулы, представленной на 2 картинке, следует, что масса раствора равна (картинка номер 6, где ω –массовая доля вещества)
m(р)(NaOH) = (4 г/ 12%) * 100% = 33,3 г
Ответ: m(NH(2)CH(2)COONa) = 9,7 г, m(р)(NaOH) = 33,3 г
m(р)(NH(2)CH(2)COOH) = 150 г
ω(NH(2)CH(2)COOH) = 5%
ω(NaOH) = 12%
m(NH(2)CH(2)COONa) - ?
m(р)(NaOH) - ?
Решение:
Из формулы на 2 картинке следует, что масса считается по формуле, представленной на 3 картинке (где ω – массовая доля
вещества)
m(NH(2)CH(2)COOH) = (150 г/ 100%) * 5% = 7,5 г
Найдем количество вещества аминоуксусной кислоты, используя формулу на 4 картинке, где ν –количество вещества, m- масса вещества, M- молярная масса вещества)
ν(NH(2)CH(2)COOH) = 7,5 г/ 75 г/моль = 0,1 моль
Как видно из уравнения реакции количество соли равно количеству аминоуксусной кислоты
ν(NH(2)CH(2)COONa) = ν(NH(2)CH(2)COOH) = 0,1 моль
По формуле, представленной на 5 картинке, найдем массу соли
m(NH(2)CH(2)COONa) = 0,1 моль * 97 г/моль = 9,7 г
Как видно из уравнения реакции количество гидроксида натрия равно количеству аминоуксусной кислоты
ν(NaOH) = ν (NH(2)CH(2)COOH) = 0,1 моль
По формуле на 5 картинке найдем массу гидроксида натрия
m(NaOH) = 0,1 моль * 40 г/моль = 4 г
Из формулы, представленной на 2 картинке, следует, что масса раствора равна (картинка номер 6, где ω –массовая доля вещества)
m(р)(NaOH) = (4 г/ 12%) * 100% = 33,3 г
Ответ: m(NH(2)CH(2)COONa) = 9,7 г, m(р)(NaOH) = 33,3 г