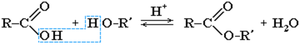Задание
Развернуть задание
В результате реакции этерификации из 150 мл безводной уксусной кислоты (плотность 1 г/мл) получили 200 г этилового эфира уксусной кислоты. Рассчитайте массовую долю выхода продукта реакции от теоретически возможного.
Развернуть задание
Новое решение
Решение
Дано:
V(CH 3 COOH) = 150 мл
ρ(CH 3 COOH) = 1 г/мл
m(CH 3 COOC 2 H 5 ) = 200 г
η вых (CH 3 COOC 2 H 5 ) -?
Решение:
V(CH 3 COOH) = 150 мл
ρ(CH 3 COOH) = 1 г/мл
m(CH 3 COOC 2 H 5 ) = 200 г
η вых (CH 3 COOC 2 H 5 ) -?
Решение:
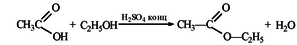
Найдем массу уксусной кислоты по формуле
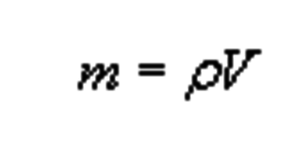
m(CH 3 COOH) = 1 г/мл * 150 мл = 150 г
По формуле:
По формуле:
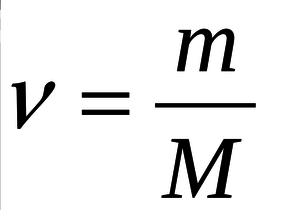
(где ν – количество вещества, m- масса вещества, M- молярная
масса вещества) найдем количество вещества уксусной кислоты
ν(CH 3 COOH) = 150 г/ 60 г/моль = 2,5 моль
Из уравнений реакций видно, что теоретическое количество вещества эфира равно количеству вещества уксусной кислоты
ν(CH 3 COOC 2 H 5 ) = ν(CH 3 COOH) = 2,5 моль
Найдем теоретическую массу эфира по формуле:
масса вещества) найдем количество вещества уксусной кислоты
ν(CH 3 COOH) = 150 г/ 60 г/моль = 2,5 моль
Из уравнений реакций видно, что теоретическое количество вещества эфира равно количеству вещества уксусной кислоты
ν(CH 3 COOC 2 H 5 ) = ν(CH 3 COOH) = 2,5 моль
Найдем теоретическую массу эфира по формуле:
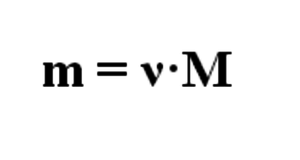
m теор (CH 3 COOC 2 H 5 ) = 2.5 моль * 88 г/моль = 220 г
По формуле:
По формуле:
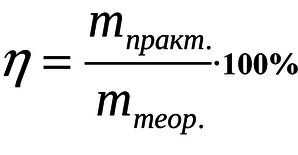
вычислим η – массовую долю выхода продукта реакции
η вых (CH 3 COOC 2 H 5 ) = (200 г/ 220 г) * 100% = 90,9%
Ответ: 90,9%
η вых (CH 3 COOC 2 H 5 ) = (200 г/ 220 г) * 100% = 90,9%
Ответ: 90,9%
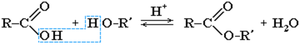
Дано:
V(CH 3 COOH) = 150 мл
ρ(CH 3 COOH) = 1 г/мл
m(CH 3 COOC 2 H 5 ) = 200 г
η вых (CH 3 COOC 2 H 5 ) -?
Решение:
V(CH 3 COOH) = 150 мл
ρ(CH 3 COOH) = 1 г/мл
m(CH 3 COOC 2 H 5 ) = 200 г
η вых (CH 3 COOC 2 H 5 ) -?
Решение:
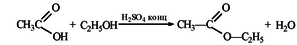
Найдем массу уксусной кислоты по формуле
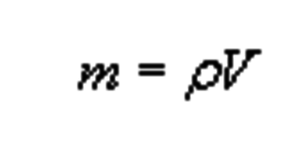
m(CH 3 COOH) = 1 г/мл * 150 мл = 150 г
По формуле:
По формуле:
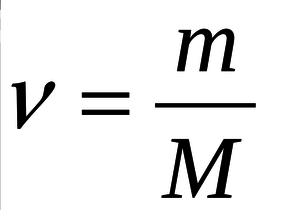
(где ν – количество вещества, m- масса вещества, M- молярная
масса вещества) найдем количество вещества уксусной кислоты
ν(CH 3 COOH) = 150 г/ 60 г/моль = 2,5 моль
Из уравнений реакций видно, что теоретическое количество вещества эфира равно количеству вещества уксусной кислоты
ν(CH 3 COOC 2 H 5 ) = ν(CH 3 COOH) = 2,5 моль
Найдем теоретическую массу эфира по формуле:
масса вещества) найдем количество вещества уксусной кислоты
ν(CH 3 COOH) = 150 г/ 60 г/моль = 2,5 моль
Из уравнений реакций видно, что теоретическое количество вещества эфира равно количеству вещества уксусной кислоты
ν(CH 3 COOC 2 H 5 ) = ν(CH 3 COOH) = 2,5 моль
Найдем теоретическую массу эфира по формуле:
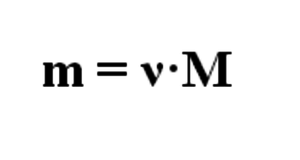
m теор (CH 3 COOC 2 H 5 ) = 2.5 моль * 88 г/моль = 220 г
По формуле:
По формуле:
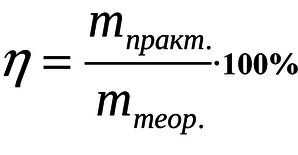
вычислим η – массовую долю выхода продукта реакции
η вых (CH 3 COOC 2 H 5 ) = (200 г/ 220 г) * 100% = 90,9%
Ответ: 90,9%
η вых (CH 3 COOC 2 H 5 ) = (200 г/ 220 г) * 100% = 90,9%
Ответ: 90,9%